Codul UDI
Reglementări privind identificarea dispozitivelor medicale și de diagnostic in vitro
La data de 25 mai 2017 au intrat în vigoare două noi reglementări: (Regulamentul (UE) 745/2017 privind dispozitivele medicale și Regulamentul (UE) 746/2017 privind dispozitivele medicale de diagnostic in vitro).
GS1 este una dintre organizațiile acreditate de organismele de reglementare pentru emiterea UDI în US, în Europa, în China, în Arabia Saudită și în Coreea de Sud. În Uniunea Europeană sunt autorizate patru organizații emitente de identificatori pentru dispozitive medicale conform Regulamentului. Acestea sunt desemnate prin Decizia de Implementare (EU) 2019/939 din Iunie 2019:
(a) GS1 AISBL
(b) Health Industry Business Communications Council (HIBCC)
(c) ICCBBA
(d) Informationsstelle für Arzneispezialitäten — IFA GmbH
Datele generale de aplicare ale celor două regulamente sunt 26 mai 2021 pentru dispozitivele medicale respectiv și 26 mai 2022 pentru dispozitivele medicale de diagnostic in vitro.
Termene relevante pentru implementare
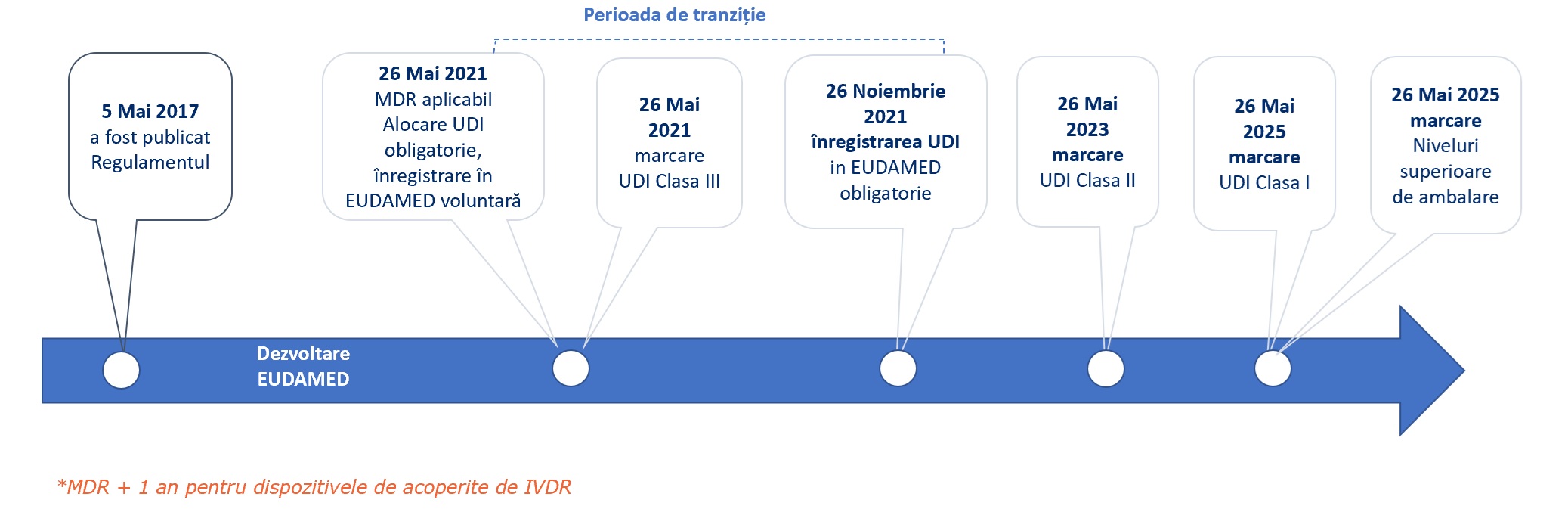
Aceste reglementări introduc un sistem de identificare la nivelul UE, bazat pe un Identificator Unic de dispozitiv (UDI), care va facilita trasabilitatea dispozitivelor medicale și va îmbunătăți semnificativ eficiența activităților legate de siguranța post-comercializare și monitorizarea de către autoritățile competente. De asemenea, va ajuta la reducerea erorilor medicale și lupta împotriva dispozitivelor falsificate.
Sistemul UDI
Un sistem care este destinat să furnizeze o identificare unică, armonizată la nivel global a dispozitivelor medicale, prin etichetarea dispozitivelor cu un identificator de dispozitiv, transpus în simbol grafic pentru AIDC si, dacă este cazul, în format lizibil, bazat pe standarde, legat de o bază de date UDI publică specifică jurisdicției.
Identificatorul Unic de Dispozitiv (UDI)
UDI-DI este un șir numeric sau alfanumeric de caractere, creat pe baza unui standard de identificare și codificare acceptat la nivel global. Acesta permite identificarea neambiguă în piață a unui anumit dispozitiv medical.
În pregătirea pentru aceste cerințe de înregistrare EUDAMED, producătorii români de dispozitive medicale/ reprezentanții autorizați pot consulta site-ul ANMDM.
